各位读者好,今天为大家带来一篇使用整合网络药理学、分子对接、分子动力学模拟(MD)、药物亲和力响应靶点稳定性(DARTS)、表面等离子共振(SPR)策略来研究荷叶碱(NF)在癌症恶病质(CC)中的作用、潜在靶点和机制的高分文章,是由石河子大学药学院和北京大学天然与仿生药物国家重点实验室团队2025年4月在Journal of Cachexia, Sarcopenia and Muscle发表的,题为“Nuciferine Attenuates Cancer Cachexia-Induced Muscle Wasting in Mice via HSP90AA1”。发现荷叶活性成分荷叶碱(NF)可改善癌症恶病质(CC)小鼠的肌肉功能障碍和骨骼肌萎缩,为抗击癌症恶病质带来了新的希望。
发表杂志:
《Journal of Cachexia, Sarcopenia and Muscle》是一本聚焦于恶病质、肌肉减少症及肌肉相关疾病的国际权威期刊,涵盖多个研究领域,由 Wiley-Blackwell 出版,创刊于2010年,隶属于国际肌肉减少症-恶病质-消耗性疾病学会(SCWD)的官方期刊。

2024 年影响因子:12.7在老年医学(Geriatrics & Gerontology)领域排名前 5%(Q1)
ISSN:2190-5991
中科院分区:医学大类 1 区,老年医学和医学:内科小类 1 区
发文量:近年发文量呈上升趋势,2023 年发表 248 篇,接受率约 23%,审稿严格且注重创新性
发表成本:APC的全价为4,910美元 / 3,120英镑 / 3,920欧元
审稿周期:平均约 16 周,但实际案例显示从投稿到接收可能需 3-8 个月,具体取决于研究复杂性
《Journal of Cachexia, Sarcopenia and Muscle》期刊致力于发表与恶病质、肌肉减少症及身体成分变化相关的基础与临床研究,凭借高影响力、严格的审稿标准及对前沿领域的关注,成为肌肉健康研究领域的顶级平台,尤其适合探讨肌肉减少症与慢性疾病关联机制及干预策略的学者投稿。
研究背景:
癌症恶病质(CC)是一种多因素综合征,表现为骨骼肌质量持续丢失,约80%的晚期癌症患者受其影响,可直接导致多达40%的癌症相关死亡。目前,尚无FDA批准的有效治疗方法来恢复CC患者的肌肉萎缩。CC的病理机制复杂,蛋白质合成和降解失衡在其发展中起重要作用。激活核因子 - κB(NF - κB)等蛋白降解途径或介质与骨骼肌质量丢失相关,而Akt–mTOR途径则主要通过增加蛋白质合成来控制骨骼肌质量。荷叶碱(NF)是荷叶的主要活性成分,具有抗炎、抗肿瘤等多种药理作用,此前研究发现其可通过NF - κB信号通路抑制脑缺血-再灌注损伤引起的炎症。这些特性使其有可能缓解CC并提高患者生活质量,但NF对CC的治疗效果和机制尚不明确。计算机模拟可预测药物候选物与靶受体的潜在相互作用,网络药理学、分子对接、分子动力学模拟等技术可用于探索药物成分、靶点与疾病之间的联系。
本文旨在探究荷叶碱(NF)预防癌症恶病质(CC)所致肌肉萎缩的靶点和机制。通过构建动物模型,结合行为测试、H&E染色等实验,发现NF可提升荷瘤小鼠肌肉力量,改善体重、肌肉质量和萎缩情况。网络药理学和分子对接预测NF主要靶向AKT1、TNF和HSP90AA1,调节相关信号通路。进一步实验证实NF通过抑制HSP90AA1/NF-κB通路减少炎症,激活AKT–mTOR通路减缓肌肉萎缩,且直接结合HSP90AA1发挥作用,提示NF或可成为治疗CC的有效药物。
研究框架:
1. 提出问题
CC是晚期癌症常见且严重的并发症,目前缺乏有效治疗方法。NF具有抗炎、抗肿瘤等多种药理活性,但对CC的治疗效果和机制尚不明确,因此提出探究NF防治CC诱导的肌肉萎缩的靶点和机制这一问题。
2. 研究框架
先通过动物实验观察NF对荷瘤小鼠肌肉功能和质量的影响,再利用网络药理学和分子对接预测NF作用的靶点和通路,最后用分子动力学模拟、DARTS和SPR等方法验证关键靶点。
3. 研究方法
动物实验:构建荷瘤小鼠模型,进行行为学测试、H&E染色和相关标志物检测。
网络药理学:从多个数据库收集NF和CC的作用靶点,构建PPI网络,进行KEGG和GO富集分析。
分子对接:预测NF与关键靶点的结合亲和力和模式。
其他方法:用Western blotting验证机制,MD、DARTS和SPR验证关键靶点。
4. 分析数据
用Prism 8.4软件进行单因素或双因素方差分析,以p < 0.05为差异有统计学意义。
5. 得出结论
NF可通过直接结合HSP90AA1,调节AKT - mTOR和NF - κB信号通路,抑制炎症反应,促进蛋白质合成,从而缓解CC诱导的肌肉萎缩,有望成为治疗CC的有效药物。

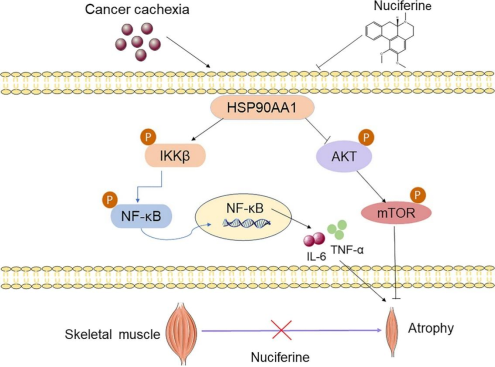
Figure 8.潜在机制示意图。
结果解析:
1. NF改善荷瘤小鼠肌肉力量
连续13天给予荷瘤小鼠NF(30mg/kg/d,腹腔注射),对荷瘤小鼠的体重、食物摄入量、肿瘤体积和肿瘤重量无显著改善。
行为测试显示,与对照组相比,LLC组在给药第7天和第13天的肢体握力显著下降,第12天的前肢悬挂时间和虚弱评分明显降低;而NF治疗显著改善了这些变化,表明NF能增强荷瘤小鼠的肌肉力量。
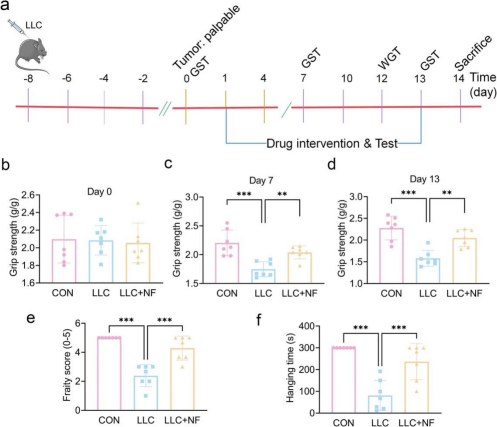
2. NF缓解荷瘤小鼠体重、肌肉质量和骨骼肌萎缩的损失
LLC组的无肿瘤体重、腓肠肌质量、股四头肌质量和附睾脂肪质量均显著低于对照组,NF治疗后这些指标的损失得到显著改善。
HE染色结果表明,LLC组骨骼肌横截面积显著低于对照组,NF治疗显著增加了荷LLC肿瘤小鼠的横截面积。
NF治疗显著降低了MyHC降解以及Atrogin1和MuRF1(参与蛋白质降解的肌肉特异性E3泛素连接酶)的激活,说明NF可有效预防荷瘤小鼠的骨骼肌萎缩。

3. 网络药理学分析
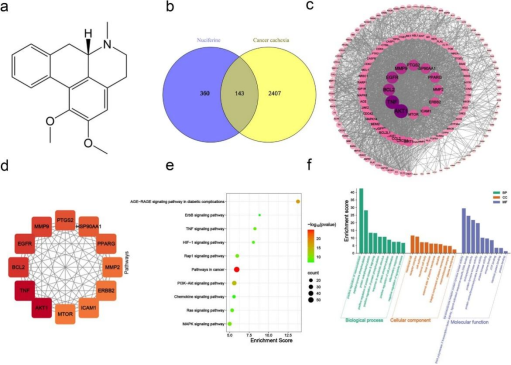
靶点预测:从多个数据库收集到NF的360个靶点和CC的2407个疾病靶点,通过Venn图映射得到143个活性成分-疾病共同靶点。
PPI网络分析:构建“蛋白质-蛋白质网络”,发现网络中有146个节点和2030条边,确定AKT1、TNF、BCL2等为关键靶点。
KEGG通路富集分析和靶点-通路网络分析:筛选出前10条KEGG通路,包括癌症相关通路、PI3K - Akt和MAPK通路,提示NF可能通过调节多个基因和信号通路减轻CC诱导的肌肉萎缩。
基因本体(GO)富集分析:预测关键靶点参与的生物过程、细胞成分和分子活动,表明炎症反应和细胞增殖的正调控是NF对抗CC的主要生物过程。
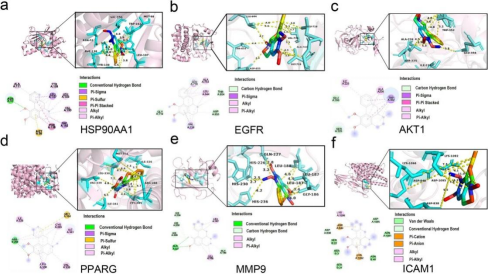
4. 分子对接
NF与筛选出的主要靶点的结合能在- 9.5至- 6.3 kcal/mol之间,表明NF与这些靶点有良好的结合。其中,NF与HSP90AA1的结合亲和力最强,其次是EGFR、AKT1等。
5. NF通过HSP90AA1/NF-κB通路抑制荷瘤小鼠肌肉的炎症反应
与对照组相比,模型组中HSP90AA1、p-IKKβ/IKKβ、p-NF-κB/NF-κB、TNF-α和IL-6的表达增加,而NF成功降低了荷瘤小鼠中这些蛋白的表达,表明NF可通过抑制HSP90AA1/NF-κB信号通路减轻CC诱导的肌肉萎缩。
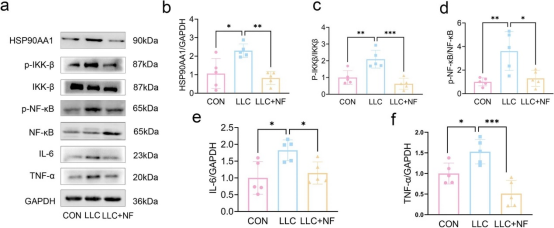
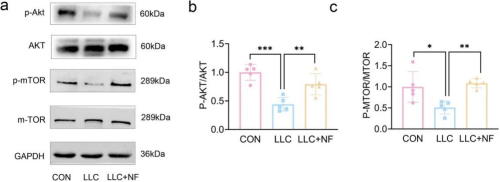
6. NF通过AKT-mTOR通路减轻CC诱导的肌肉损失
与LLC组相比,LLC+NF组中p-AKT/AKT和p-mTOR/mTOR蛋白水平显著增加,提示NF可能通过激活AKT-mTOR信号通路延缓小鼠CC诱导的肌肉萎缩。
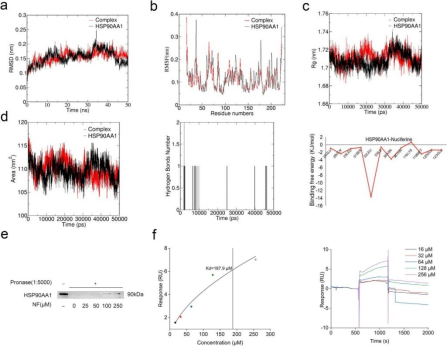
7. NF直接结合HSP90AA1
分子动力学模拟(MD):HSP90AA1-NF系统的RMSD在模拟过程中小于0.22 nm,复合物结构更稳定,波动更小,关键结合残基可能在29-38位。结合自由能为-77.281 kJ/mol,范德华力是主要贡献者,LEU-32和ASN-35可能是关键结合位点。
DARTS实验:NF干预以浓度依赖的方式抑制了链霉蛋白酶诱导的HSP90AA1蛋白降解,表明NF特异性结合HSP90AA1蛋白。
SPR亲和力测定:Kd为187.9 μM,表明NF与HSP90AA1有很强的结合关系,提示NF通过直接靶向HSP90AA1延缓CC诱导的肌肉萎缩。
研究结论:
本研究发现荷叶活性成分荷叶碱(NF)可改善癌症恶病质(CC)小鼠的肌肉功能障碍和骨骼肌萎缩。NF通过直接靶向HSP90AA1,一方面抑制NF-κB通路,调节IL-6和TNF-α等促炎细胞因子的释放;另一方面促进AKT-mTOR通路的激活,从而减轻CC诱导的肌肉萎缩,表明NF可能是治疗CC的潜在先导化合物。
研究的创新性:
首次发现NF可通过直接结合HSP90AA1,调节AKT-mTOR和NF-κB信号通路,延缓CC诱导的肌肉萎缩。运用网络药理学、分子对接、分子动力学模拟等多技术手段,全面深入探究NF治疗CC的靶点和机制,为CC治疗药物研发提供新思路。
研究的不足之处:
研究仅使用雄性小鼠进行实验,未探究NF对雌性小鼠CC的作用,可能存在性别差异导致的结果偏差。此外,不清楚NF是调节细胞外还是细胞内的HSP90AA1来减轻CC肌肉萎缩,需要进一步研究。
研究展望:
后续可开展NF对雌性小鼠CC作用的研究,以明确性别差异对治疗效果的影响。利用抑制剂或基因敲除技术,深入研究NF调节HSP90AA1的具体方式,是细胞外还是细胞内调节。还可进行临床试验,验证NF在人体中治疗CC的有效性和安全性,推动其向临床应用转化。
研究意义:
本研究为CC治疗提供了新的潜在药物NF,揭示了其作用靶点和机制,有助于深入理解CC的发病机制。为开发治疗CC的新药提供理论依据,有望改善CC患者的肌肉萎缩症状,提高患者生活质量,具有重要的临床应用前景。