真核细胞中的蛋白质翻译加工主要有两条途径,一条是信号肽引导的内质网-高尔基体途径,即分泌途径,另一条是游离核糖体途径。前者包括分泌蛋白、膜蛋白和溶酶体蛋白,后者主要是胞浆蛋白、核蛋白和一些细胞器蛋白。
分泌途径的翻译主要在内质网完成,而另一条途径是在游离核糖体上完成翻译,然后被特异定位标签引导进入线粒体、叶绿体、过氧化物酶体及细胞核等处,没有标签的就留在胞浆。
2004年诺贝尔化学奖颁发给以两名色列和一名美国科学家,以表彰他们发现了泛素调节的蛋白质降解,从此拉开了研究生物体泛素化修饰的序幕;
泛素(Ubiquitin)是一种由76个氨基酸组成的小分子多肽,存在于真核生物的所有组织中;在哺乳动物、酵母和植物之间只有三种氨基酸的差异,泛素表现出显著的进化保守性;
人类基因组中的四个基因编码泛素:UBB,UBC,UBA52和RPS27A,所编码的泛素多肽可聚集形成多聚泛素链;
泛素化系统降解蛋白质的原理:
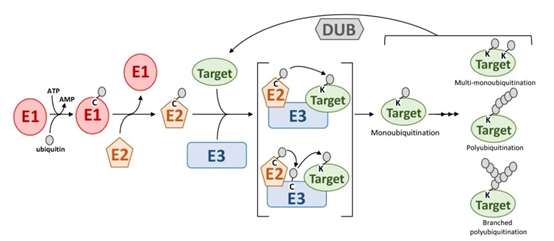
(1)泛素活化酶( ubiquitin activating enzyme,E1) 在ATP的参与下催化泛素C 末端的甘氨酸( Gly ), 形成泛素-腺苷酸中间产物, 然后激活的泛素被转移至E1酶的半胱氨酸(Cys)残基上。
(2)活化的泛素通过转酰基作用进一步转移到泛素结合蛋白( ubiquitin conjugating enzyme, E2)上, 形成E2-泛素巯基酯。
(3)E2- 泛素复合体接下来可以有两种方式与要降解的底物蛋白质结合: 一是直接从E2 转移给底物蛋白质形成泛素- 蛋白质复合体; 二是底物蛋白质首先与泛素连接酶( ubiquitin ligating enzyme, E3) 结合, 然后底物蛋白质与E2 转移的泛素结合。在所有依赖E3 的连接和一些非依赖E3 的连接反应中, 多个泛素单元可与底物蛋白质连接成泛素多聚链, 各个泛素单体之间连接的位点主要是第48 位的赖氨酸( Lys48) 。最终泛素- 蛋白质复合体主要是被一种沉降系数为26S 的蛋白酶体所识别降解, 少数被溶酶体和小泡内的酶降解。同时由泛素C 末端水解酶( Ub C terminal hydrolase) 释放泛素供再循环利用。E3对靶蛋白的特异性识别在泛素调节路径中起决定作用。
(Stone, Sophia L., 2019)
泛素化是一个可逆的过程,它存在一个重要的对立机制——去泛素化,这一途径的存在,使得调控可以向两个方向进行,提高了细胞内的信号通路的多样性。
去泛素化作用原理:催化水解泛素分子C末端的多肽链连接,即从活性硫醇位点将泛素与靶蛋白拆开,从而去除和解聚底物蛋白质上的多聚泛素键,防止多聚泛素在底物蛋白的聚集(Kim JH et al., 2003)。
目前已在人类发现的有600多种E3连接酶;在稳定状态下,可以检测到数千个细胞内蛋白上的20000个泛素化位点(Clague et al., 2015; Kim et al., 2011; Udeshi et al., 2013);
E3连接酶(根据结构域的不同)主要分两种类型:HECT结构域以及RING结构域。HECT结构域的E3连接酶先自身结合泛素然后将泛素转移至底物,而RING结构域的E3连接酶使E2酶直接将泛素转移至底物(Husnjak K et al., 2012);
E3对靶蛋白的特异性识别在泛素调节路径中起决定作用。
小结:
泛素-蛋白水解酶体途径(UPP)是通过E1、E2、E3酶系统将泛素或泛素样蛋白标记到靶蛋白,从而蛋白酶体将其降解的过程,生物体为保持平衡,还存在对立的去泛素化系统,即水解泛素与靶蛋白的连接。E3连接酶特异性识别靶蛋白,在UPP过程中起决定性作用,因此对泛素化的研究主要集中在E3连接酶与靶蛋白之间相互作用的研究。