研究亮点
首次揭示了在焦亡中线粒体的损伤机制。线粒体损伤发生在细胞膜破裂之前,这表明它是焦亡中的早期事件。这种线粒体损伤是通过GSDMD-NT与存在于线粒体膜上的心磷脂的结合所引发的。

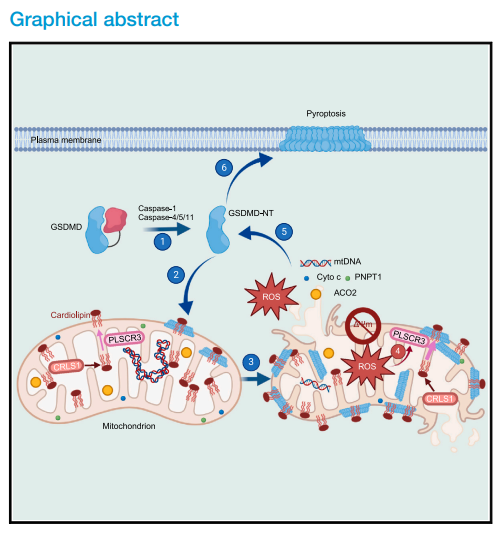
机制模式图
研究背景
炎症小体——细胞哨兵的卫士
当免疫细胞和上皮感知到病原体和危险信号时,会组装炎症小体,激活caspases(caspase-1、-4、-5和-11)相关蛋白。这包括通过经典炎症小体激活的Caspase-1,以及通过与侵入性革兰氏阴性细菌LPS和内源性氧化磷脂结合激活的人源caspases-4和-5以及鼠源caspase-11形成的非经典炎症小体。
Gasdermin D(GSDMD)是这些炎症caspases的底物,执行炎症小体诱导的焦亡,通过释放N末端(NT)形成孔的片段。这个N末端片段(GSDMD-NT)结合到细胞膜上的负电荷磷脂质,形成破坏细胞膜的膜孔,释放炎症因子,包括白细胞介素-1(IL-1)。
线粒体——细胞命运与免疫调控的中心
在凋亡中,BAX和BAK激活通过渗透线粒体外膜(OMM),释放凋亡因子至细胞质,触发线粒体外膜渗透(MOMP)并形成凋亡小体。
Caspase-9的激活提供了强大的正反馈机制,被称为“不可逆点”。凋亡后期的线粒体通透性转变(mPT)破坏线粒体内膜,导致持续的线粒体去极化。
非caspase介导的程序性细胞死亡,如颗粒酶介导的杀伤、坏死性凋亡和镁离子死亡,也可引起ROS生成和膜电位丧失,但大多数情况下并不涉及线粒体外膜透化(MOMP)
心磷脂(cardiolipin,CL)
心磷脂是线粒体内膜的主要磷脂之一,是线粒体内膜的特征性磷脂。心磷脂的合成是在线粒体内膜上完成的。磷脂酸在外膜(OM)转移到内膜(IM),经过CDP二酰甘油(CDP-DG)、磷脂酰甘油磷酸(PGP)和磷脂酰甘油(PG),在IM的基质面上转化为CL。心磷脂与线粒体中多种蛋白复合物的组装和活性有关。呼吸链复合物I至V和溶质载体家族的蛋白质均已显示与CL紧密结合。CL不仅结合于这些蛋白的表面上,也促进它们组装成超复合体,并稳定其结构。
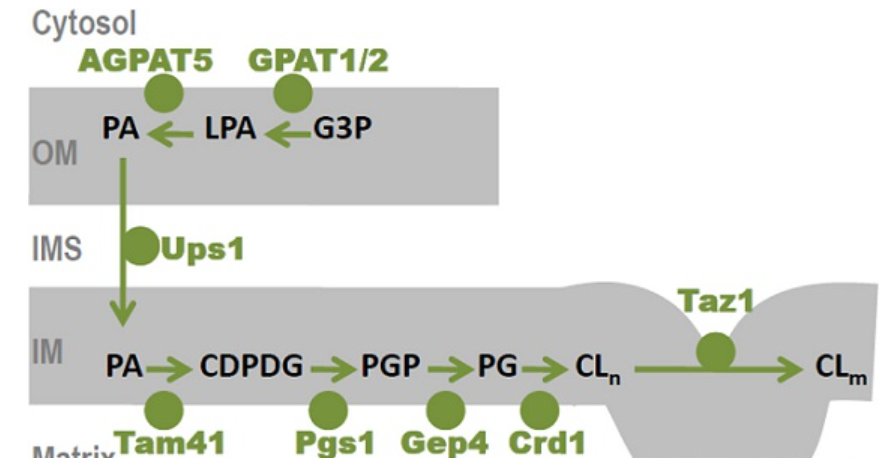
Biosynthesis, remodeling and turnover of
mitochondrial cardiolipin. Biochim Biophys Acta Mol Cell Biol Lipids. 2017
Jan;1862(1):3-7.
焦亡过程中的线粒体——GSDMD和GSDME引导的早期损伤
在GSDMD和GSDME介导的焦亡早期,线粒体遭受损害,表现为ROS上升、膜电位下降、细胞色素c和mtDNA释放到细胞质。
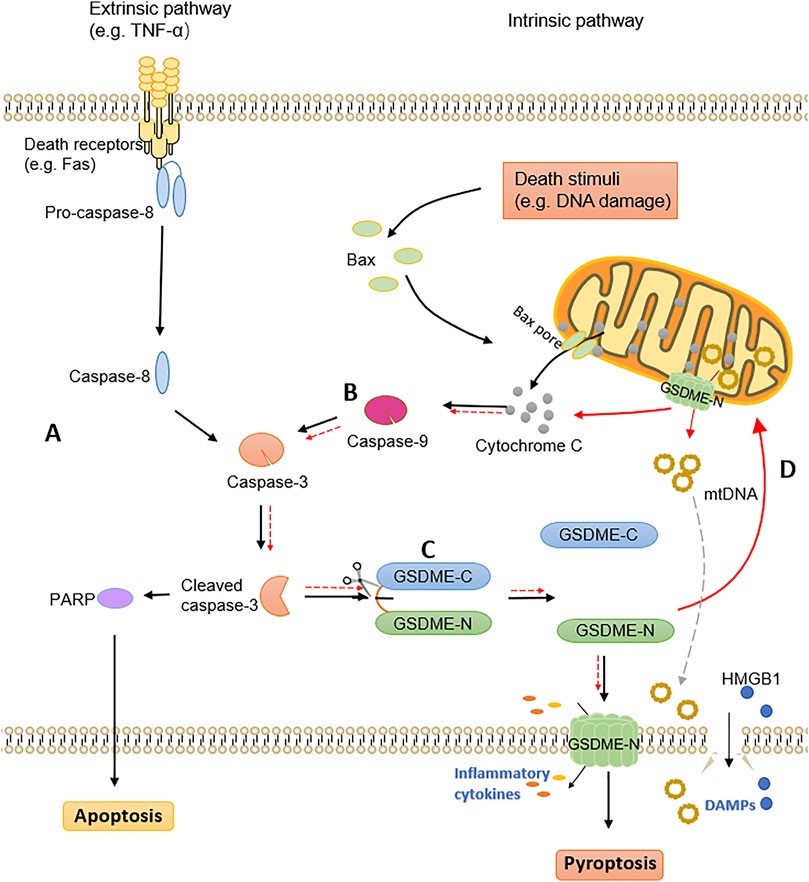
Liao XX, Dai YZ, Zhao YZ, Nie K. Gasdermin A
Prospective Target for Therapy of Diseases. Front Pharmacol. 2022 Apr
6;13:855828
GSDMD激活的焦亡会导致线粒体损伤,但其具体的分子机理和作用机制还尚不清楚。
研究摘要
Gasdermin D (GSDMD) 激活的炎症细胞死亡(焦亡)会导致线粒体损伤,但其潜在机制和功能在很大程度上是未知的。在这里,作者发现 N 端成孔 GSDMD 片段迅速破坏线粒体内膜和线粒体外膜导致线粒体数量减少、线粒体自噬、ROS、跨膜电位丧失、氧化磷酸化减弱以及线粒体蛋白和 DNA 从基质和膜间空间释放。在质膜损伤之前,一旦GSDMD被切割,线粒体损伤就会发生。线粒体损伤独立于 B 细胞淋巴瘤 2 家族,并且依赖于 GSDMD-NT 与心磷脂的结合。线粒体损伤、焦亡和炎性细胞因子释放的典型和非典型炎症小体激活通过心磷脂合酶(Crls1)或将心磷脂转移到OMM的干扰酶(Plscr3)的敲除来抑制。肿瘤中的磷脂干扰酶-3(Plscr3)缺乏抑制了焦亡触发的抗肿瘤免疫。因此,线粒体损伤在细胞焦亡中起着关键作用。
研究结果
研究者发现,在焦亡过程中,THP-1细胞的线粒体形态和功能发生显著变化:线粒体变小变圆,平均长度减半,数量减少,且出现自噬体内含有受损线粒体。1小时后,大部分线粒体嵴丢失或膜结构断裂,显示线粒体在焦亡早期就遭受严重破坏。
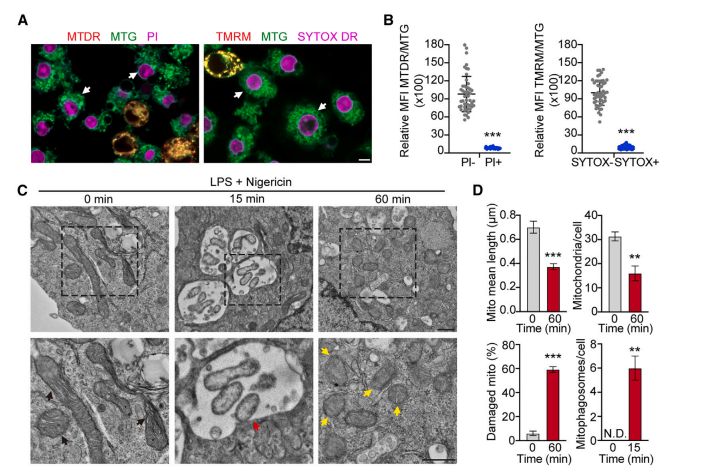
作者观察到,经nigericin处理后,GSDMD-NT能在细胞质膜破坏前使线粒体的内外膜通透,导致线粒体内容物(如细胞色素c、ACO2和mtDNA)释放到胞浆并进入培养基。这一过程伴随着caspase-1的增加和GSDMD的切割,从而增加了GSDMD-NT。
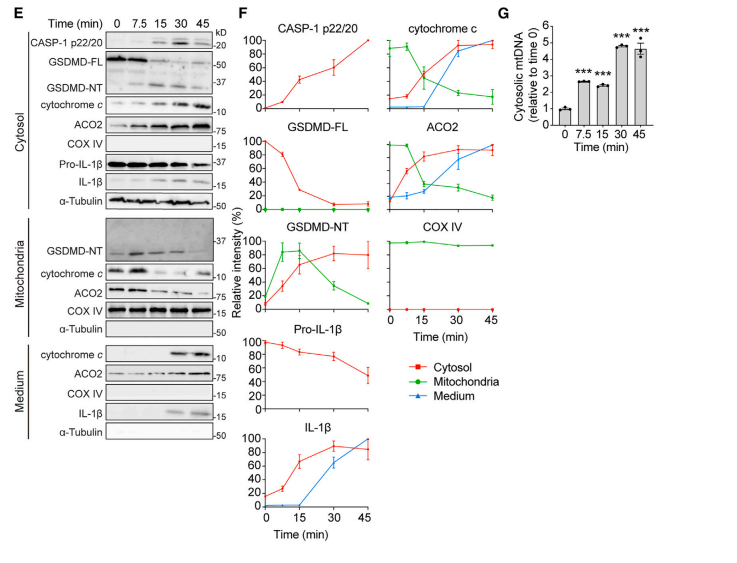
接下来,研究进一步评估了经LPS+nigericin处理的THP-1的线粒体膜电位(TMRM强度)、细胞ROS生成(DCFDA强度)和质膜通透性(SYTOX Green吸收)。结果证明线粒体功能障碍先于细胞死亡。
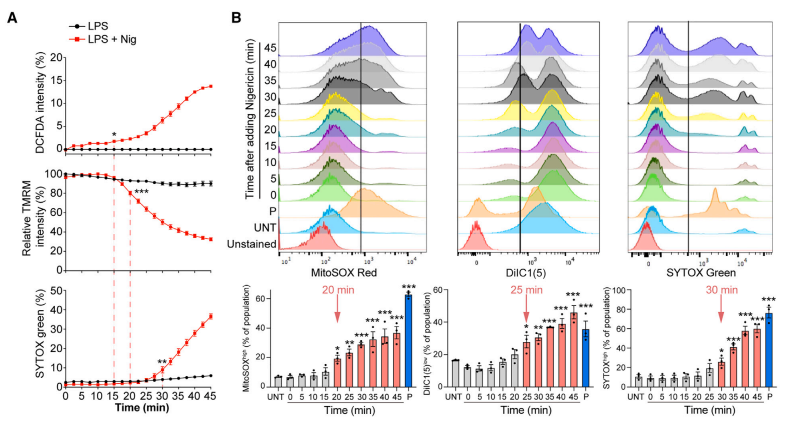
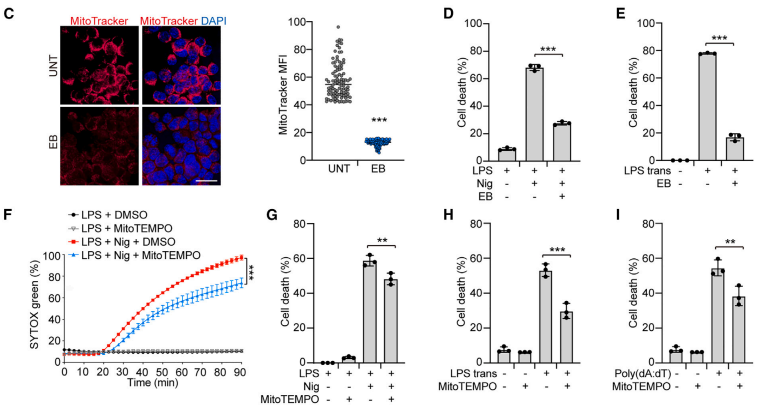
作者使用溴化乙锭处理小鼠骨髓巨噬细胞以构建线粒体缺失的细胞模型,并通过CellTiter-Glo检测发现线粒体对细胞焦亡至关重要,线粒体缺失能抑制焦亡。此外,使用Mito TEMPO清除线粒体ROS后,细胞死亡受到限制,进一步证实线粒体在焦亡中扮演重要角色。
诱导焦亡后,线粒体发生损伤,线粒体对于焦亡至关重要,焦亡是如何影响的线粒体呢?一个潜在的可能是GSDMD-N端“打洞”线粒体。为了确定GSDMD-NT是否与线粒体结合并介导线粒体功能障碍,研究者构建了GSDMD-NT-BFP蓝色荧光融合蛋白。
GSDMD-NT-BFP至少在质膜通透前50分钟与线粒体染料定位,证实了GSDMD-NT早期靶向线粒体。在 PI 或 SYTOX 吸收之前,MitoTracker 和 TMRM 强度逐渐降低,而 MitoSOX 信号增加。所有线粒体标记最终消失,表明线粒体溶解。
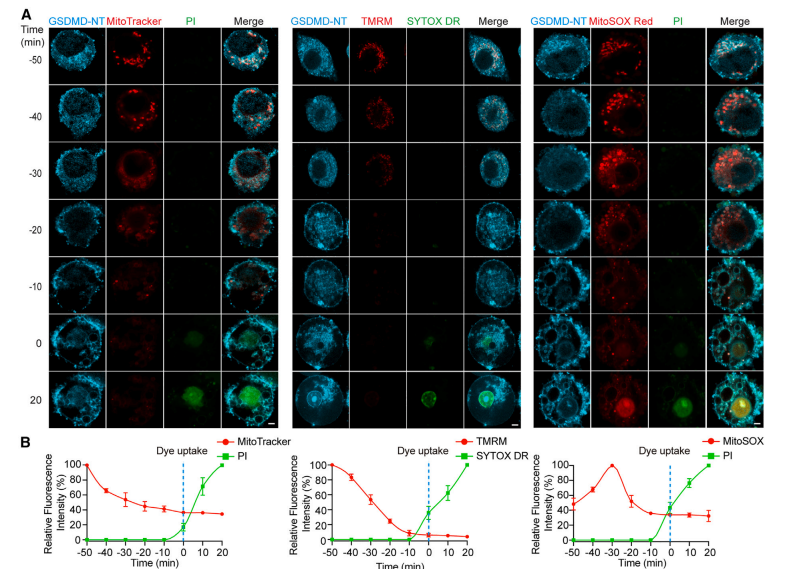
为了证实 GSDMD-NT 与线粒体的共定位,作者在 HEK293T 中表达了 FLAG 标记的 GSDMD-FL 或 -NT。后续实验结果证实GSDMD-NT与线粒体共定位,并在细胞膜通透前定位于线粒体。
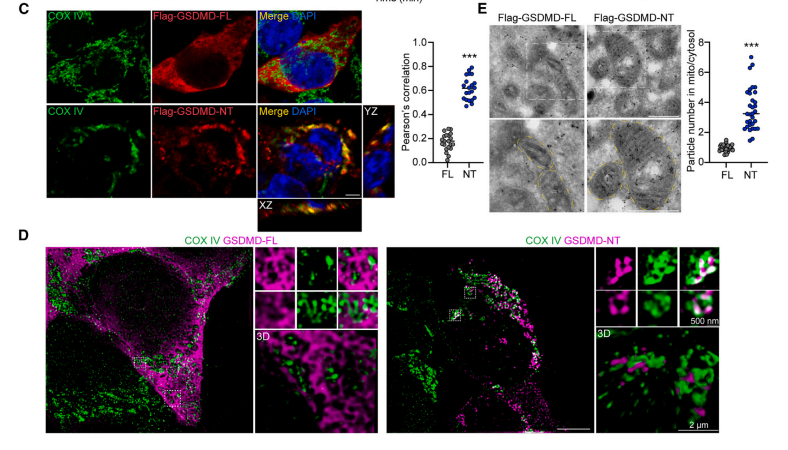
为了确定 GSDMD-NT 本身是否会结合并破坏线粒体膜,用重组 GSDMD 和 caspase-11 处理分离的线粒体以生成活性 GSDMD-NT,并通过对释放的线粒体蛋白进行免疫印迹来评估线粒体的通透性。
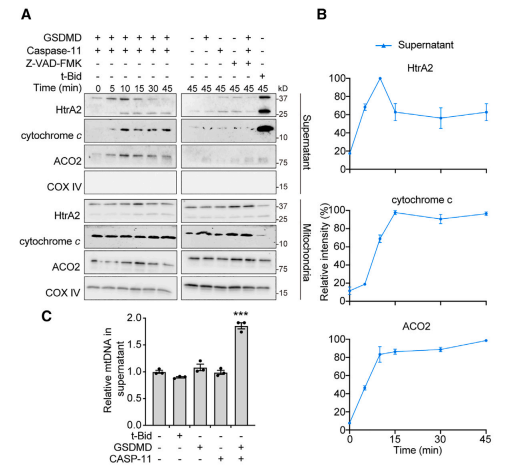
通过MitoSOX Red和DiIC1染色法,GSDMD和caspase-11处理分离的线粒体也分别显著增加了ROS和降低了膜电位。进一步为了证实GSDMD-NT孔在线粒体膜损伤中的作用,研究者在加入GSDMD和caspase-11之前先将分离的线粒体与DSF预孵育(单纯抑制GSDMD打孔),结果发现,DSF阻止了线粒体释放细胞色素c和mtDNA,暗示焦亡过程GSDMD-NT孔能使线粒体通透,损伤线粒体。
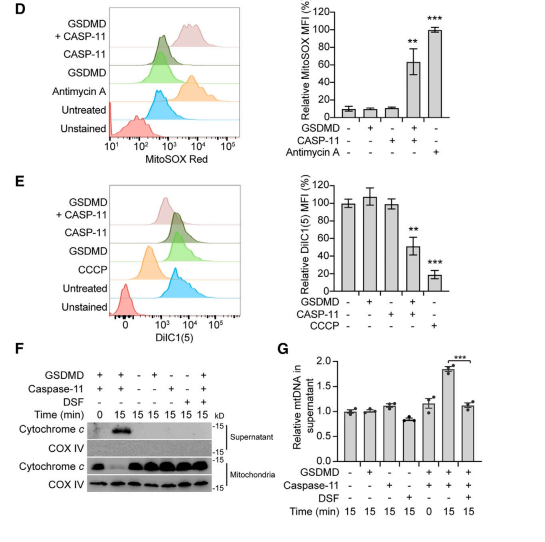
那么,GSDMD-NT如何到线粒体呢?GSDMD-NT与心磷脂具有很高的亲和力,而线粒体膜不含其他已知的与GSDMD-NT结合的脂质,因此研究者假设线粒体损伤取决于线粒体心磷脂。心磷脂由心磷脂合酶(Crls1)合成,并由磷脂干扰酶-3(Plscr3)外化至外膜(OMM),为了研究OMM心磷脂是否为GSDMD-NT介导的线粒体损伤所必需,研究者在iBMDMs细胞中对Crls1和Plscr3进行了基因敲除。
在经LPS+nigericin处理的Crls1-/-和Plscr3-/-iBMDMs中,GSDMD-NT没有被招募到线粒体,线粒体完整性和膜电位、线粒体数量和平均长度以及受损线粒体百分比几乎恢复到未经焦亡诱导的WT iBMDMs中的水平。
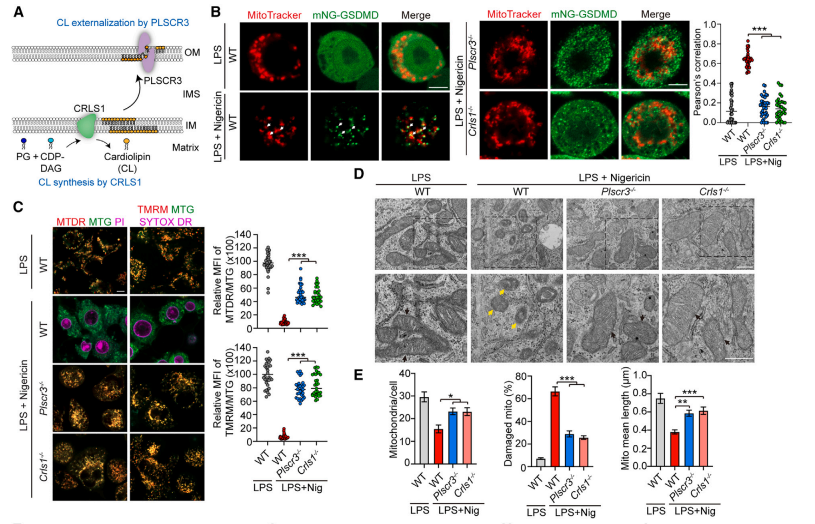
此外,线粒体ROS以及细胞色素c和mtDNA的胞浆释放也被阻断。这些数据表明OMM心磷脂介导了GSDMD依赖性线粒体损伤。
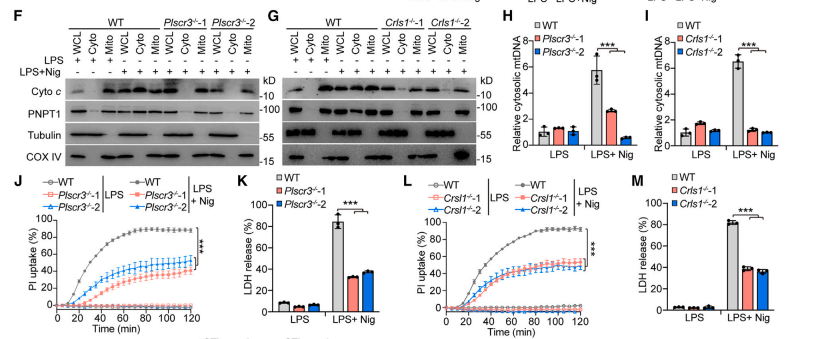
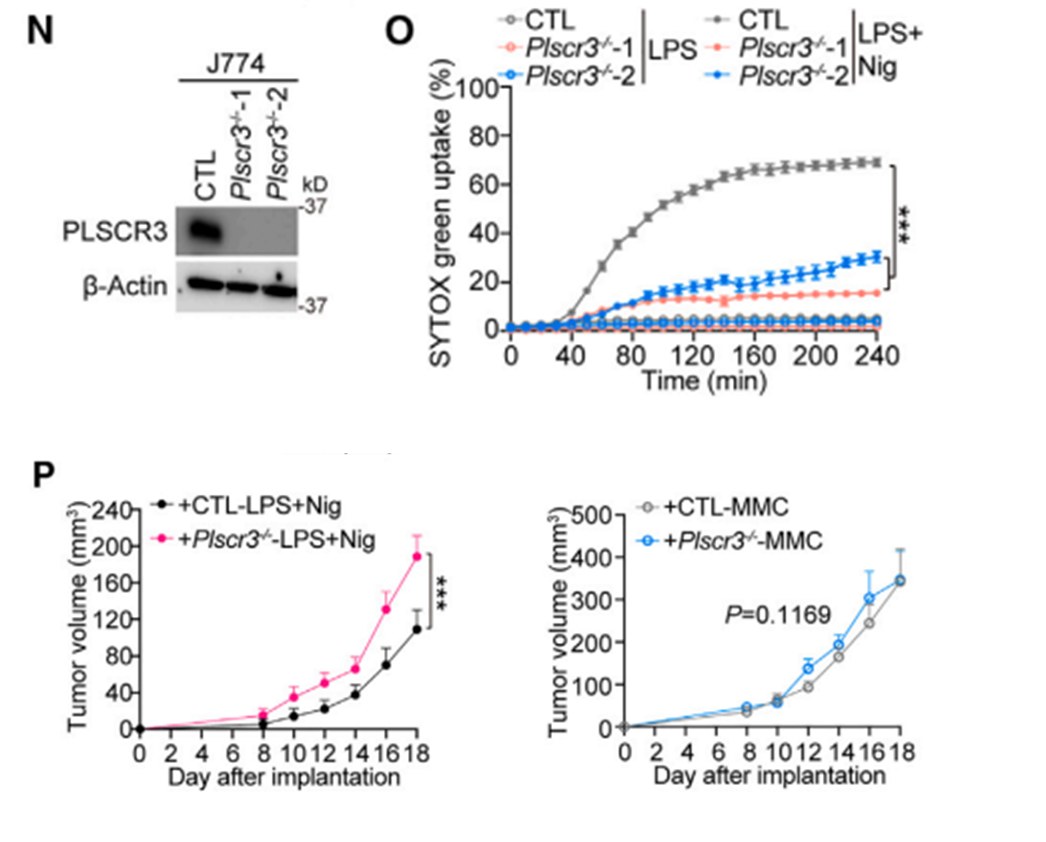
为了研究线粒体损伤在体内的免疫作用,研究者在敲除了J774细胞中的Piscr3,结果发现,与对照组相比,在Plscr3-/- J774细胞中,LPS+nigericin刺激的焦亡显著减少。
而为了评估线粒体损伤在焦亡性免疫原性细胞死亡(ICD)中的重要性,研究者设计了体内实验,结果表明线粒体损伤促进细胞焦亡诱导体内抗肿瘤免疫。
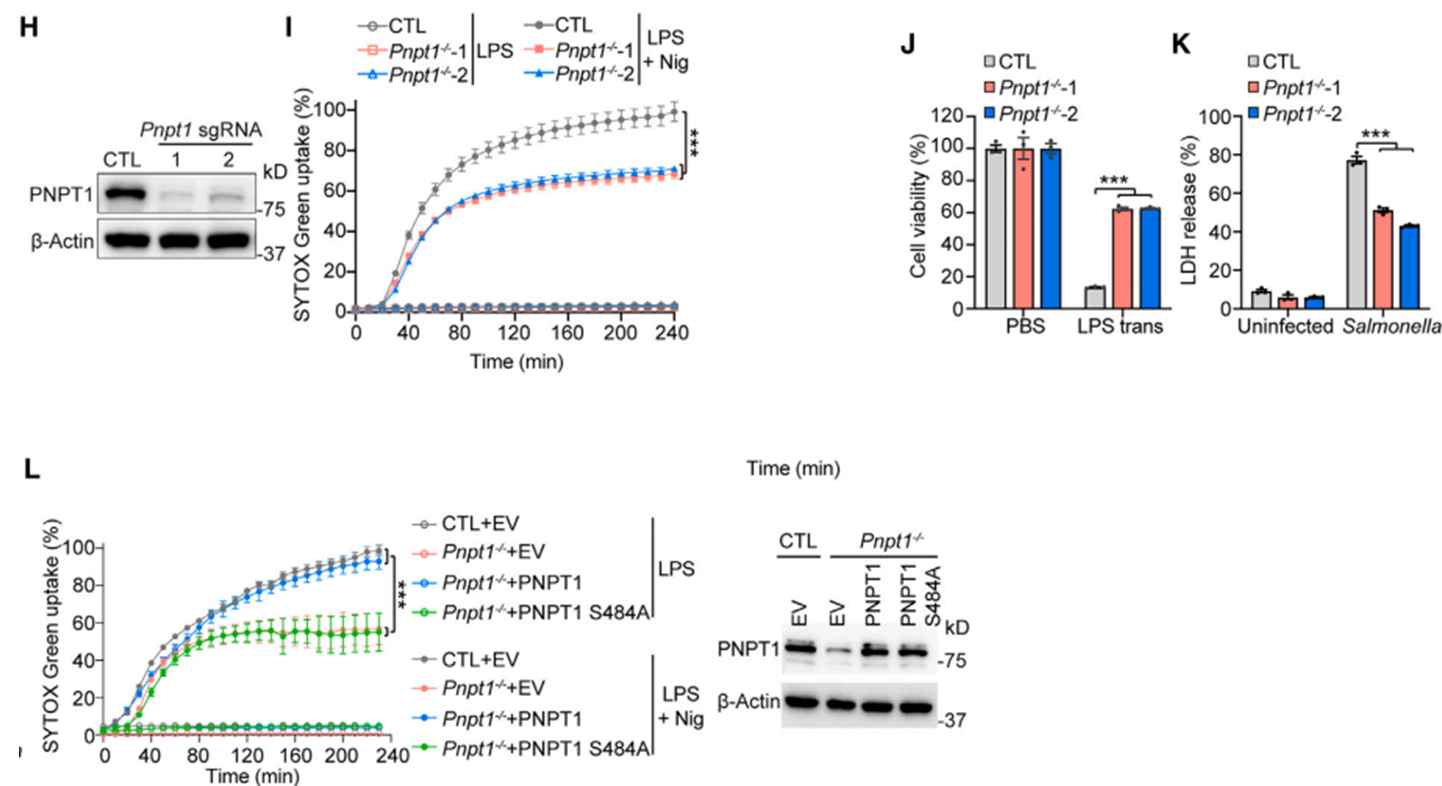
在细胞凋亡过程中,MOMP(线粒体外膜透化作用) 会释放 PNPT1(IMS 中的一种外切核酸酶),启动全局 mRNA 降解,从而促进细胞凋亡。由于焦亡也会触发 MOMP,因此 PNPT1 很可能也会释放到细胞膜,并在焦亡过程中触发 mRNA 降解。
为了验证这一观点,作者通过免疫荧光显微镜和免疫印迹法分析了 PNPT1 在 LPS- 和 LPS+ nigericin 处理的 iBMDM 中的定位情况.在 LPS 诱导的细胞中,PNPT1 定位于线粒体,但加入 nigericin 后则移至细胞膜。不出所料,PNPT1 在 Plscr3-/- 和 Crls1-/- iBMDM 中释放受阻。通过荧光原位杂交检测 18S rRNA 和 poly(A) mRNA,在 WT 中检测不到 mRNA 信号,而在 Plscr3-/- 和 Crls1-/- iBMDMs 中 rRNA 没有明显变化。

分别在Plscr3-/-和Crls1-/-iBMDMs中异位表达WT PLSCR3和CRLS1,可恢复由nigericin或沙门氏菌诱导的焦亡mRNA衰减。OMM心肌磷脂是PNPT1诱导的焦亡mRNA降解所必需的。

为了研究PNPT1介导的mRNA降解是否有助于焦亡,用nigericin、LPS转染或沙门氏菌处理WT和Pnpt1-/-iBMDM。结果表明Pnpt1缺乏会明显减轻焦亡且PNPT1介导的mRNA衰变促进了焦亡。
结论与意义
这项研究的最终结论:线粒体在焦亡中扮演了至关重要的角色。线粒体的损伤不仅会引发细胞死亡,还会导致炎症。通过揭示这一机制,研究为我们提供了更深入了解焦亡的机制和潜在的治疗途径,特别是在免疫反应和抗肿瘤免疫方面。这项研究有望为炎症性疾病和肿瘤治疗的未来提供新的思路。