研究背景
胰腺导管腺癌(PDAC)是一种高度侵袭性的癌症,其转移倾向(尤其是向肝脏和肺部)与患者预后密切相关。尽管已知代谢重编程在肿瘤转移中起关键作用,但决定PDAC细胞在特定器官定植的核心机制尚不明确。本研究聚焦于PCSK9(前蛋白转化酶枯草溶菌素9),一个已知参与胆固醇代谢调控的基因,探索其在PDAC转移器官选择中的作用。
研究内容
1. 器官偏好的分群与验证
利用MetMap500数据库分析25种PDAC细胞系的转移潜能,发现两类亚群:
Cluster 1(C1-Liver):偏好肝脏定植,低表达PCSK9,依赖LDL-胆固醇摄取。
Cluster 2(C2-Lung):偏好肺部定植,高表达PCSK9,依赖胆固醇合成。
通过小鼠模型验证:C1细胞经脾内注射后形成肝脏转移,而C2细胞经尾静脉注射后形成肺部转移。
2. PCSK9的功能机制
胆固醇代谢调控:
C1-Liver细胞:低PCSK9导致LDLR高表达,促进LDL-胆固醇摄取,激活mTORC1信号(通过溶酶体胆固醇积累),并通过CYP46A1生成24-羟胆固醇(24-HC),重塑肝脏微环境。
C2-Lung细胞:高PCSK9抑制LDLR,激活远端胆固醇合成途径(如7-脱氢胆固醇,7-DHC),通过其抗氧化特性抵抗铁死亡(ferroptosis),适应肺部高氧环境。
器官选择的可塑性:
过表达PCSK9可使肝脏偏好细胞转向肺部转移,而敲除PCSK9或过表达LDLR可使肺部偏好细胞转向肝脏转移。
3. 临床相关性
患者样本分析显示:
肝脏转移灶:低PCSK9、高LDLR、低分化(基底样特征)。
肺部转移灶:高PCSK9、低LDLR、高分化(经典亚型特征)。
TCGA数据分析:PCSK9表达与经典亚型标志物(如GATA6)正相关,与基底样标志物(如ZEB1)负相关。
研究方法
1. 多组学整合分析:结合MetMap转移潜能数据、DepMap基因依赖数据、TCGA转录组数据,筛选PCSK9作为关键候选基因。
2. 体外功能实验:
CRISPR敲除/过表达PCSK9、LDLR、CYP46A1等基因,验证其对胆固醇代谢和细胞增殖的影响。
代谢分析:检测LDL摄取(Dil-LDL)、胆固醇分布(Filipin染色)、远端胆固醇中间体(7-DHC、7-DHD)含量。
3. 体内模型:
通过脾内注射(靶向肝脏)、尾静脉注射(靶向肺部)和心内注射(自发转移)评估器官特异性定植。
光片显微镜(3D成像)和流式细胞术追踪细胞在器官内的分布。
4. 临床样本验证:免疫组化分析患者原发灶和转移灶中PCSK9、LDLR及分化标志物的表达。
研究结果
1. 器官选择机制:
PCSK9通过调控LDLR决定细胞依赖外源胆固醇摄取(肝脏)或内源合成(肺部)。
C1-Liver细胞的24-HC分泌激活肝细胞LXR信号,促进胆固醇外排,形成促肿瘤微环境。
C2-Lung细胞的7-DHC和7-DHD通过捕获自由基抑制铁死亡,抵抗肺部氧化应激。
2. 靶向干预潜力:
抑制PCSK9或增强LDLR表达可重编程转移偏好。
补充7-DHC/7-DHD可增强肝脏偏好细胞的肺部定植能力。
创新性与价值
1. 科学创新:
首次揭示PCSK9在肿瘤转移中的双重作用:不仅调控胆固醇代谢,还通过代谢产物影响器官特异性微环境适应。
提出“胆固醇代谢可塑性”作为转移器官选择的决定性因素,突破了传统上对转移机制的单一路径认知。
2. 临床意义:
PCSK9表达可作为PDAC转移部位和预后的生物标志物。
靶向PCSK9-LDLR轴或胆固醇合成通路(如SC5D、DHCR7)可能成为治疗策略:
肝脏转移:联合mTORC1抑制剂或LXR拮抗剂。
肺部转移:联合铁死亡诱导剂(如RSL3)或阻断远端胆固醇合成。
3. 后续研究方向:
探索PCSK9在其他癌种(如乳腺癌、结直肠癌)转移中的普适性。
开发基于PCSK9抑制剂(如alirocumab)的联合疗法,结合代谢干预与免疫治疗。
解析肿瘤微环境中胆固醇代谢的细胞间交互作用(如肿瘤细胞-肝细胞/肺上皮细胞)。
总结
本研究通过多维度实验揭示了PCSK9在PDAC转移中的核心作用,不仅深化了对肿瘤代谢异质性的理解,还为个体化治疗提供了新靶点。其创新性在于将胆固醇代谢的动态平衡与器官特异性适应机制相结合,为癌症转移研究开辟了新的代谢视角。
数据展示如下:
数据一:PDAC细胞存在器官转移偏好(肝 vs. 肺),且这种偏好由细胞固有特性决定,与KRAS等驱动突变无关。通过多维度实验证明PDAC细胞系具有明确的器官转移倾向性,并建立了两类亚群(C1-Liver和C2-Lung),为解析其代谢调控机制提供关键模型。
1)、基于MetMap500数据库分析25种PDAC细胞系的转移潜能(器官特异性定植能力)和穿透性(转移效率),通过主成分分析(PCA)将其分为两类:
Cluster 1(C1-Liver):肝脏转移潜能高(70.6%),穿透性强(37.9%)。
Cluster 2(C2-Lung):肺部转移潜能显著(31.2%),穿透性更高(51.3%)。
花瓣图直观展示不同细胞系在脑、骨、肾、肝、肺的转移倾向(图a-b)。
2)体内验证器官偏好:
肝脏定植:C1细胞经脾内注射后,生物发光成像(图d-e)和H&E染色(图f-g)显示显著肝脏肿瘤生长,而C2细胞几乎无肝脏定植。
肺部定植:C2细胞经尾静脉注射后,在肺部形成明显转移灶(图h-k),而C1细胞肺部定植能力极低。
细胞分布动态追踪:
混合注射C1(mCherry标记)和C2(eGFP标记)细胞后,光片显微镜(图m)显示:
肝脏:C1细胞形成大病灶,C2细胞极少。
肺部:C2细胞占主导,C1细胞几乎消失(图n)。
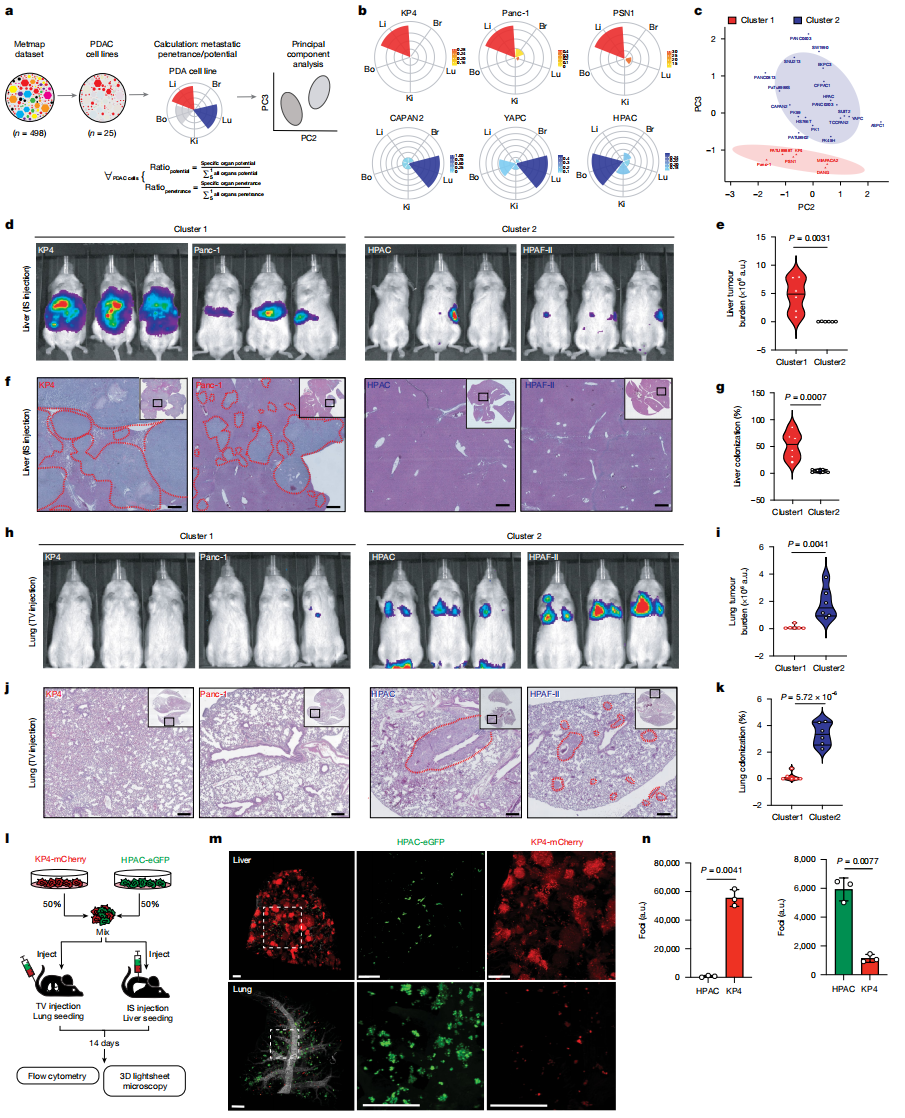
图1 PDAC细胞系的器官转移偏好差异及其验证
数据二:PCSK9表达水平是PDAC器官转移偏好的关键标志物,通过调控LDLR介导的胆固醇摄取能力决定细胞在肝/肺微环境中的生存优势。
1)基因表达关联性:
PCSK9是C2-Lung细胞(肺转移偏好)中最显著高表达的基因,与经典亚型标志物(GATA6、CDH1)正相关,与基底亚型标志物(ZEB1、VIM)负相关(图a-b)。
免疫印迹显示:C2-Lung细胞高表达PCSK9且LDLR蛋白水平低,而C1-Liver细胞反之(图b)。
2)胆固醇代谢调控机制:
PCSK9通过促进LDLR溶酶体降解,抑制细胞对LDL-胆固醇的摄取(图c)。
临床样本验证:
肝脏转移灶:低PCSK9、高LDLR(图d-g);
肺部转移灶:高PCSK9、低LDLR(图h-i)。
3)亚型与器官偏好关联:
单细胞测序显示:经典亚型(肺转移)中PCSK9高表达,基底亚型(肝转移)中表达缺失(补充数据)。
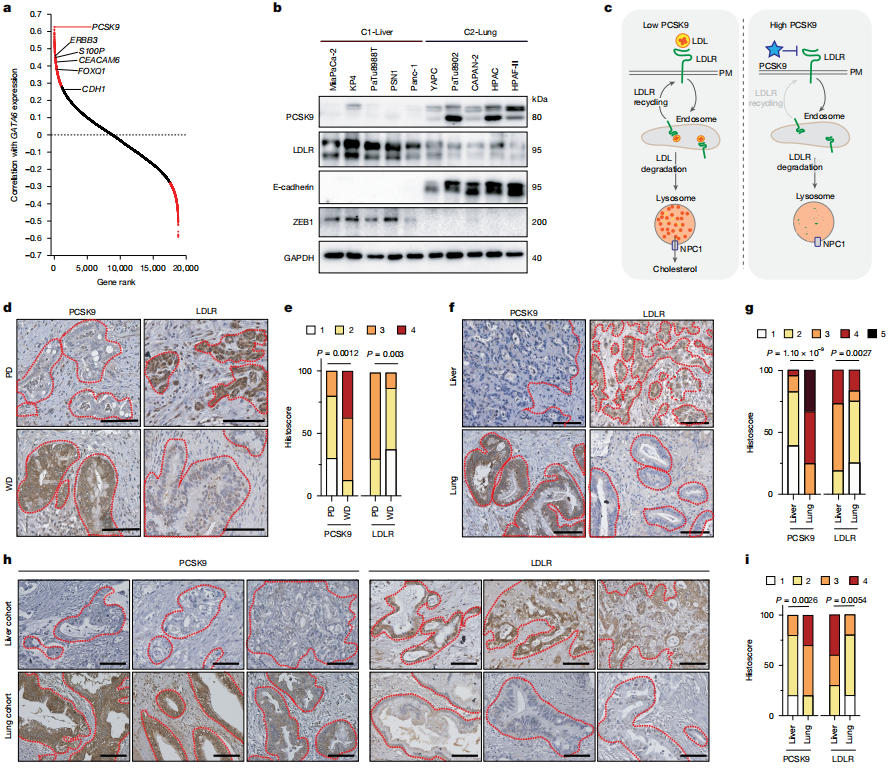
图2 PCSK9表达与PDAC转移器官选择及胆固醇代谢调控的关联
数据三:PCSK9通过切换胆固醇代谢模式(摄取 vs. 合成)决定PDAC细胞器官特异性适应,是器官转移偏好的直接驱动因子。
1)胆固醇依赖性的器官适应:
C1-Liver细胞:在脂蛋白缺失血清(LPDS)中生长受抑制,需外源LDL-胆固醇维持增殖(图a-b);敲除胆固醇摄取相关基因(如LDLR)显著降低其存活(图d)。
C2-Lung细胞:依赖胆固醇合成(尤其是远端合成酶如FDFT1、SQLE),敲除这些基因导致其生长受损(图c)。
2)PCSK9的因果作用:
过表达PCSK9(功能增强型D374Y):
抑制C1-Liver细胞的LDLR表达(图e),减少肝脏定植,但增强肺部转移能力(图f-h)。
敲除PCSK9:
上调C2-Lung细胞的LDLR,抑制胆固醇合成基因,逆转其肺部偏好,促发肝脏转移(图i-l)。
3)关键代谢节点验证:
HMGCR(甲羟戊酸途径限速酶):所有细胞均依赖其活性,提示早期胆固醇合成通路的普适性需求(图c-d)。
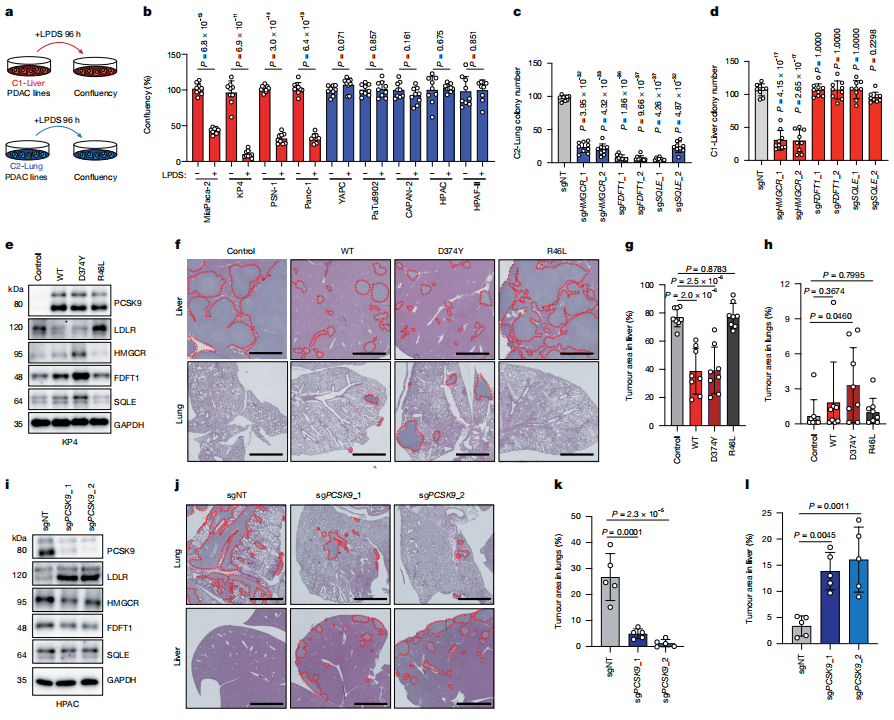
图3 PCSK9通过调控胆固醇代谢途径决定PDAC器官转移偏好的功能性机制
数据四:C1-Liver细胞通过胆固醇-mTORC1轴维持自身增殖,并通过分泌24-羟胆固醇(24-HC)“劫持”肝细胞代谢,构建促转移微环境,揭示了肿瘤-基质代谢互作在器官转移中的关键作用。
1)胆固醇驱动mTORC1激活:
C1-Liver细胞通过LDL摄取积累溶酶体胆固醇,促进mTORC1信号(磷酸化S6和4EBP1),而脂蛋白缺失(LPDS)显著抑制该通路(图a-b)。
患者肝转移灶中mTORC1活性(p-S6)显著高于肺转移灶(图c-d)。
2)胆固醇代谢产物重塑微环境:
C1-Liver细胞高表达CYP46A1,将胆固醇转化为24-HC(图e-f)。
24-HC通过旁分泌激活肝细胞中的LXR受体,诱导胆固醇外排基因(如ABCA1),促进肝细胞释放胆固醇,形成“自我喂养”循环(图g-j)。
3)功能验证:
敲除CYP46A1阻断24-HC生成,抑制LXR靶基因激活,显著降低C1-Liver细胞的肝脏定植能力(补充数据)。
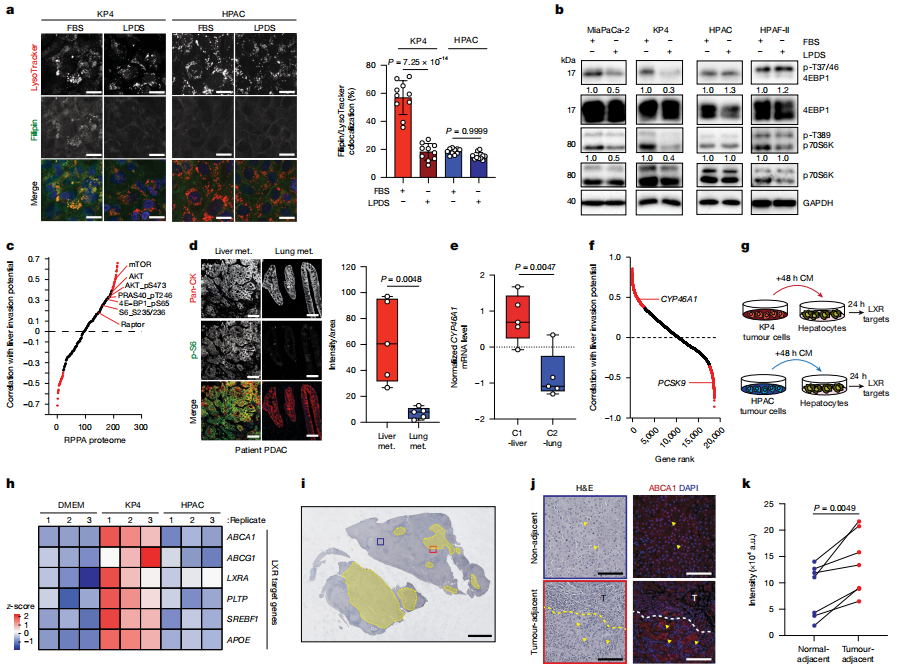
图4 解析了肝脏偏好细胞(C1-Liver)如何利用胆固醇激活关键信号通路并重塑肝脏微环境
数据五:肺转移细胞通过PCSK9驱动的远端胆固醇合成途径产生抗铁死亡代谢物(7-DHC/7-DHD),是其适应肺部氧化应激微环境的关键生存机制。
1)抗铁死亡代谢物的生成:
C2-Lung细胞高表达SC5D、DHCR7等远端胆固醇合成酶,显著积累7-脱氢胆固醇(7-DHC)和7-脱氢脱氢胆固醇(7-DHD)(图a-c)。
这些中间体的5,7-二烯结构具有自由基捕获能力,抑制脂质过氧化(图a)。
2)铁死亡抵抗功能验证:
C2-Lung细胞对铁死亡诱导剂(RSL3、ML210)的敏感性显著低于C1-Liver细胞(图f)。
外源添加7-DHC或7-DHD可特异性保护C2-Lung细胞免于铁死亡,而补充其他脂类无效(图g-i)。
3)PCSK9的调控作用:
过表达PCSK9(D374Y)增强C1-Liver细胞的远端胆固醇合成能力,提高7-DHC/7-DHD水平并赋予其肺转移能力(图d-e,补充数据)。
敲除SC5D(阻断7-DHC合成)显著削弱C2-Lung细胞的肺部定植(补充数据)。
4)临床意义:
靶向远端胆固醇合成(如抑制SC5D)或诱导铁死亡,可能成为抑制PDAC肺转移的新策略(图l)。
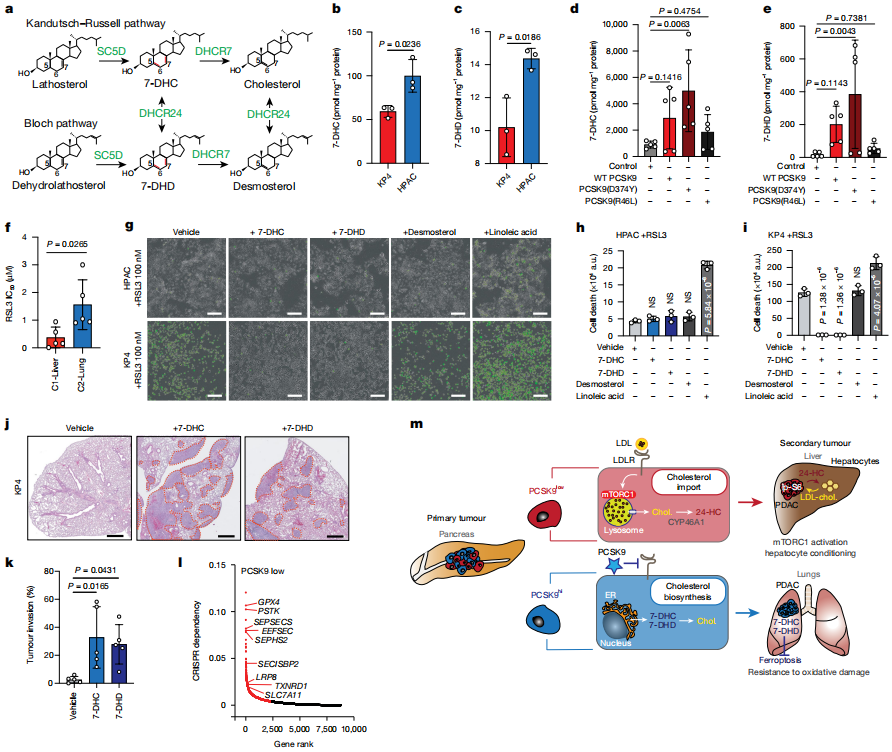
图5揭示了肺转移偏好细胞(C2-Lung)通过远端胆固醇合成途径产生抗铁死亡代谢物,从而适应高氧肺部微环境的机制