【研究背景:肝脏再生的“谜题”】
肝脏是人体唯一具有强大再生能力的器官,即使切除70%,也能在几周内恢复如初。但这一过程如何精准调控?哪些细胞和分子在幕后“指挥”?长期以来,科学界对肝脏再生的机制存在争议。
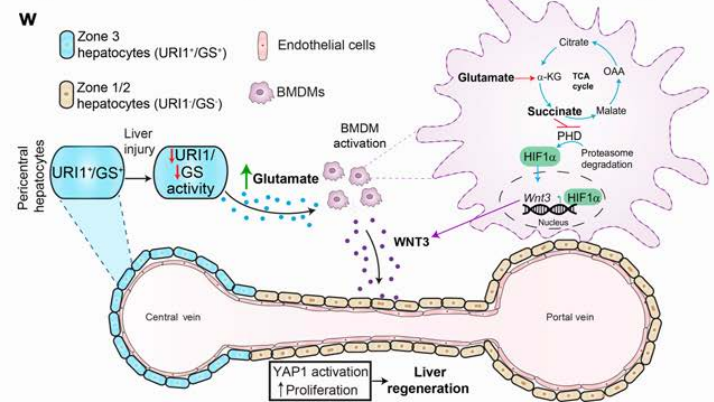
传统观点认为,肝脏中的“干细胞样”细胞(如中央静脉周围的zone 3肝细胞)是再生的主力军。但最新研究发现,中央静脉附近的肝细胞通过释放谷氨酸,竟然能远程“指挥”另一种免疫细胞——巨噬细胞,成为肝脏修复的“核心引擎”。这项研究由西班牙国立癌症研究中心团队完成,成果发表于《自然》杂志。
【研究方法:基因编辑+代谢追踪】
为了揭秘肝脏再生的机制,研究团队设计了多组精巧实验:
- 基因敲除小鼠:特异性敲除肝细胞中的URII蛋白(一种调控谷氨酰胺合成酶GS的分子),观察肝脏再生速度的变化。
- 单细胞测序:分析不同区域肝细胞的基因表达特征,锁定关键信号通路。
- 代谢组学:追踪谷氨酸在血液和肝脏中的动态变化,及其对巨噬细胞的影响。
- 骨髓移植:将高谷氨酸小鼠的骨髓移植到再生能力弱的个体中,验证巨噬细胞的核心作用。
【关键发现:谷氨酸是再生“加速器”】
- URII蛋白的“刹车”作用:
中央静脉周围的肝细胞高表达URII蛋白,它能激活谷氨酰胺合成酶(GS),将谷氨酸转化为谷氨酰胺。当URII被敲除时,谷氨酸水平飙升,肝脏再生速度显著加快(比正常小鼠快2倍以上)。 - 巨噬细胞的“代谢变身”:
升高的谷氨酸被巨噬细胞吸收后,通过代谢产生α-酮戊二酸,进而稳定HIF1α蛋白(缺氧诱导因子)。HIF1α像“指挥官”一样,激活巨噬细胞分泌WNT3信号分子。 - YAP1通路启动肝细胞增殖:
WNT3信号作用于肝细胞,触发YAP1蛋白入核,启动细胞增殖程序。这一过程不依赖经典的β-catenin通路,揭示了全新的再生调控机制。 - 谷氨酸的“双刃剑”效应:
低浓度谷氨酸(1%)可显著促进再生,但浓度超过5%时,巨噬细胞功能受损,反而不利修复。这为临床应用划定了安全范围。
【临床应用:肝病治疗新希望】
- 肝硬化与肝切除患者:
肝硬化患者肝脏谷氨酸水平偏低,补充谷氨酸或抑制URII/GS通路,可激活巨噬细胞,促进功能恢复。动物实验中,谷氨酸治疗使肝硬化小鼠存活率提高50%。 - 肝移植的辅助策略:
在90%肝切除的小鼠中,谷氨酸联合门静脉分流术可避免肝功能衰竭,为终末期肝病提供新思路。 - 药物开发靶点:
靶向URII蛋白的小分子抑制剂、WNT3激动剂等,可能成为未来肝再生治疗的核心药物。
【结论:肝脏再生的“协作网络”】
这项研究颠覆了传统认知:肝脏再生不是某类细胞的“单打独斗”,而是中央静脉肝细胞、巨噬细胞、代谢信号共同编织的精密网络。谷氨酸作为关键信使,架起了细胞间对话的桥梁。未来,通过调控这一通路,我们或许能让肝脏修复“快进”,挽救更多生命。
一句话总结:
肝脏受损后,中央静脉肝细胞释放谷氨酸,激活巨噬细胞的HIF1α-WNT3轴,最终通过YAP1驱动再生——缺了谁,都修不好这座“生命工厂”!
拓展思考:
若将这一机制应用于其他器官(如心脏、肾脏),能否解锁更广泛的再生医学潜力?谷氨酸代谢是否也是癌症生长的“帮凶”?这些问题等待科学家进一步探索。